先日、経口タイプの新型コロナワクチンの臨床試験が始まったことがニュースになっていました。もちろん、接種が簡単になることは大歓迎なのですが、更に、人間が備えている腸管での免疫調節機能を知れば、もっと素晴らしさが解るはずです。
でも、難解なアルツハイマーの経口ワクチンにたどり着くには、アミロイドβについてもう少し深い知識がいるとです。前回投稿も参考にしていただき、経口ワクチン療法の扉をたたいてみるとです。
急に九州弁になっているのは、自信の無さの表れです。大丈夫かな~
第一話 話題沸騰の「アデュカヌマブ」を冷ややかな目線で検証した結果は⁉
第二話 【今さら聞けないアルツハイマー病】これを読めば、もう大丈夫かも?
「膜貫通型蛋白質」ってなんじゃらホイ?
アミロイドβの原料になるのは「膜貫通型蛋白質」です。膜貫通型蛋白質は、細胞や細胞小器官の膜に埋め込まれた状態の蛋白質で、その全体量は体中にある総蛋白質の約30%を占めていると言われています。まずは、膜貫通型蛋白質について豆知識を身に付けましょう。
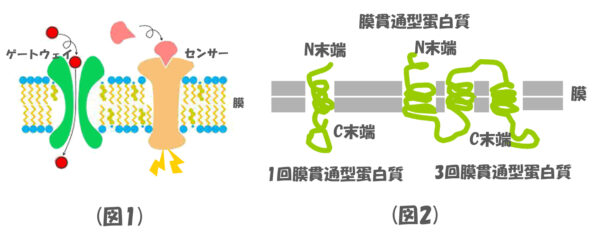
(図1)の説明
膜貫通型蛋白質の主な役割は、特定の物質だけを通過させるゲートウェイの役割や、細胞の外からやってくる様々なシグナル分子(神経伝達物質、ホルモン、種々の生理活性物質等)を選択的に感知するセンサーの役割を担っています。
(図2)の説明
キーワードとして覚えておく必要があるのですが、蛋白質はmRNAの遺伝情報に基づき、リボソームで合成され、N末端(蛋白質分子式の左端)からC末端(蛋白質分子式の右端)に向かって翻訳されます。そのため、蛋白質における重要な標的シグナルは、N末端の方に含まれる場合がほとんどです。また、蛋白質が膜を何回貫くかで、〇回膜貫通型蛋白質と記載されます。
膜貫通型蛋白質を切断する「セクレターゼ」ってなんじゃらホイ?
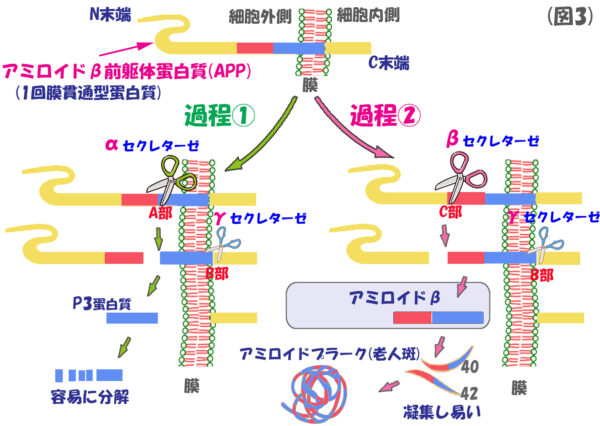
(図3)の説明
アミロイドβの原料となるアミロイド前躯体蛋白(APP)は、「1回膜貫通型蛋白質」で、約700個のアミノ酸残基(アミノ酸がペプチド結合により脱水され、元のアミノ酸化学式が少しだけ形を変えているので残基と呼びます)で構成されています。このアミロイド前躯体蛋白が、2 種類の酵素で切断されることによってアミロイドβが生産されるのです。
過程①では、最初に、α-セクレターゼが膜貫通型蛋白質のほぼ真ん中のA部を切って、その後、γ-セクレターゼがB部を切断して、P3という小さい蛋白質が残ります。この蛋白質は、非常に小さいペプチド(一次構造の直線的な蛋白質)であるため容易に分解されて、最後には何も残らなくなります。
ところが、過程②では、β-セクレターゼがC部を切断し,次にγ-セクレターゼが(過程①と同様)B部を切断します。結果、アミロイドβは 40 番目のアミノ酸残基(バリン)で終わるアミロイドβ40 と,さらに 2 個のアミノ酸残基(イソロイシンとアラニン)を加えたアミロイドβ42 ができるのです。このアミロイドβ42は凝集性が強い厄介者で、アミロイドβ40までも巻き込んでアミロイドプラーク(老人斑の素となるモジャモジャ)を形成するのです。
じぁ~、β-セクレターゼをブロックすれば過程②が成立せず、理論的にはアルツハイマー病を防げるんじゃん!
βセクレターゼがダメなら、γセクレターゼ様にお願いするしかないやろ!
確かに、β-セクレターゼを作れないようにしたマウスの体内には、アミロイドβが見当たりませんでした。ところが、どうも行動がおかしいという報告があり、β-セクレターゼは、他にも重要な役割を担っていることが示唆されたのです。
実際、β-セクレターゼが切断している蛋白質は、他にもいくつかあって、糖転移酵素やリンパ球の膜貫通蛋白であるCD44などの重要な酵素や受容体蛋白も切断(代謝)していたのでした。従って、他の蛋白質の切断も止めてしまうと、深刻な代謝異常を起こす可能性があるため、現在、β-セクレターゼを阻害するアプローチは取られていないようです。
一方、消炎鎮痛剤を長期服用している関節リューマチの患者さんには、アルツハイマー病が少ないという報告から、消炎鎮痛剤がセクレターゼの働きを抑えているのではないかということが考えられたのです。実際、凝集しやすいアミロイドβ42を下げてくれる消炎鎮痛剤が複数見つかったのでした。
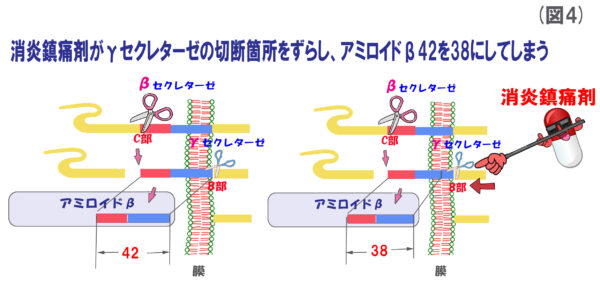
(図4)の説明
作用機序としては、消炎鎮痛剤がγ-セクレターゼと結合することによって、切断位置を狂わせ、普段は42番目のアミノ酸残基にハサミが入るのに、38番目にハサミが入ってしまうのです。結果、アミロイドβ42ができにくくなるのではないかと言われています。すなわち、γ-セクレターゼ阻害薬でなく、γ-セクレターゼ作動薬と言えるのでしょうね。
消炎鎮痛剤のうち、特にイブプロフェンが優位にアミロイドβ42の産生を抑えてくれるそうです。
γ-セクレターゼの手元を狂わせるという発想は素晴らしいと思いますが、イブプロフェンをダラダラと長期的に服用することは現実的ではありません。β-セクレターゼがダメなら、γ-セクレターゼに注目し、一刻も早く予防薬を開発して欲しいものです。
えっ~、アルツハイマーのワクチン療法って、20年前に発表されてたの?
アルツハイマー病のワクチン療法は、1999年、アメリカの製薬企業のElan社のシェンク博士が最初に報告し、ヒトでの治験(合成したアミロイドβ42を抗原として注射)も実施されました。しかしながら、副反応としての急性の髄膜脳炎が 298 人中 18 人に発症したので,その後の治験は中止されました。原因としては、アミロイドβ42の免疫を増強するために加えた薬剤(アジュバンド)がT細胞を過度に刺激してしまい、T細胞起因の過度な自己免疫によって、脳が攻撃されたものと考えられています。
こうした昔の方法には、「アジュバンドによる過剰な自己免疫の惹起」や「頻回投与によるイディオタイプ抗体の出現」(作った抗体が抗原になり、その抗体にくっくつ新たな抗体ができてしまう)が課題となっていました。
ご承知のとおり最新の新型コロナワクチンは、合成したい蛋白質(抗原)の遺伝情報を油の膜やアデノウィルスに包んで注射をし、体内で作った蛋白質(抗原)に必要な免疫をかける方法です。アルツハイマー経口ワクチンの本題に入る前に、はなはだ僭越でございますが、私の方から少しばかり整理をさせていただきたいと思います。
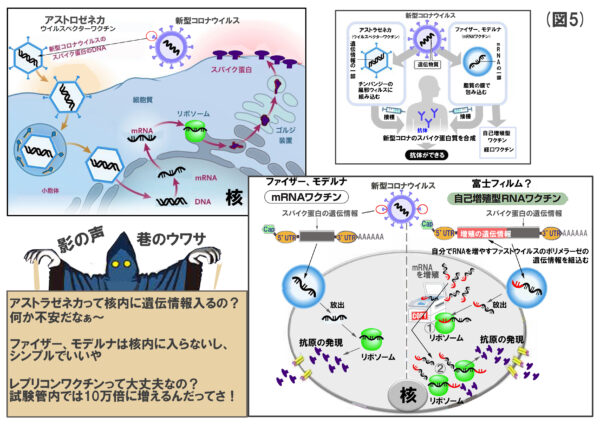
(図5)の説明
気になるのは何といっても自己増殖型RNAワクチン(レプリコンワクチン)ですよね。mRNAが自己増殖してくれるおかげで、投与量がファイザー製ワクチンなどの10分の1以下程度になる可能性があるそうです。
しくみは、感染症ウイルスの一群にアルファウイルス属というウイルスがおりまして、このアルファウイルスは、自分でmRNAを増やす蛋白質(ポリメラーゼ)を持っていることが知られていました。つまり、自己増殖させる遺伝情報と作りたい抗原蛋白質の遺伝情報をつないで接種すると、まず、細胞の中で増殖を手伝うポリメラーゼ作られ、次に増えたmRNAから抗原蛋白質がドバっと作られるという訳です。
ちなみに、大量にmRNAが作られても、細胞内には次から次へとmRNAをぶっ壊す酵素が大量にあるので、バランスが取れるそうですよ。
全世界の多人数を対象とするようなワクチン接種には欠かせない技術です。創薬ベンチャー、VLPセラピューティクス・ジャパンの赤畑渉先生、大分大学、富士フィルムの皆さ~ん。応援しています。ノーベル賞、頑張ってください。
経口ワクチンを制する者は世界を制す!な~んてね
アルツハイマー病の経口ワクチンについては、先駆けとなる、どえりゃ~日本人学者がいらっしゃったので紹介したいと思います。国立長寿医療センター研究所の原先生と田平(たびら)先生の共同研究で発表された講演内容(2003年12月 第125 回日本医学会シンポジウム)を、はなはだ僭越ではございますが、私めの解釈とかみ砕いた絵で紹介させていただきます。
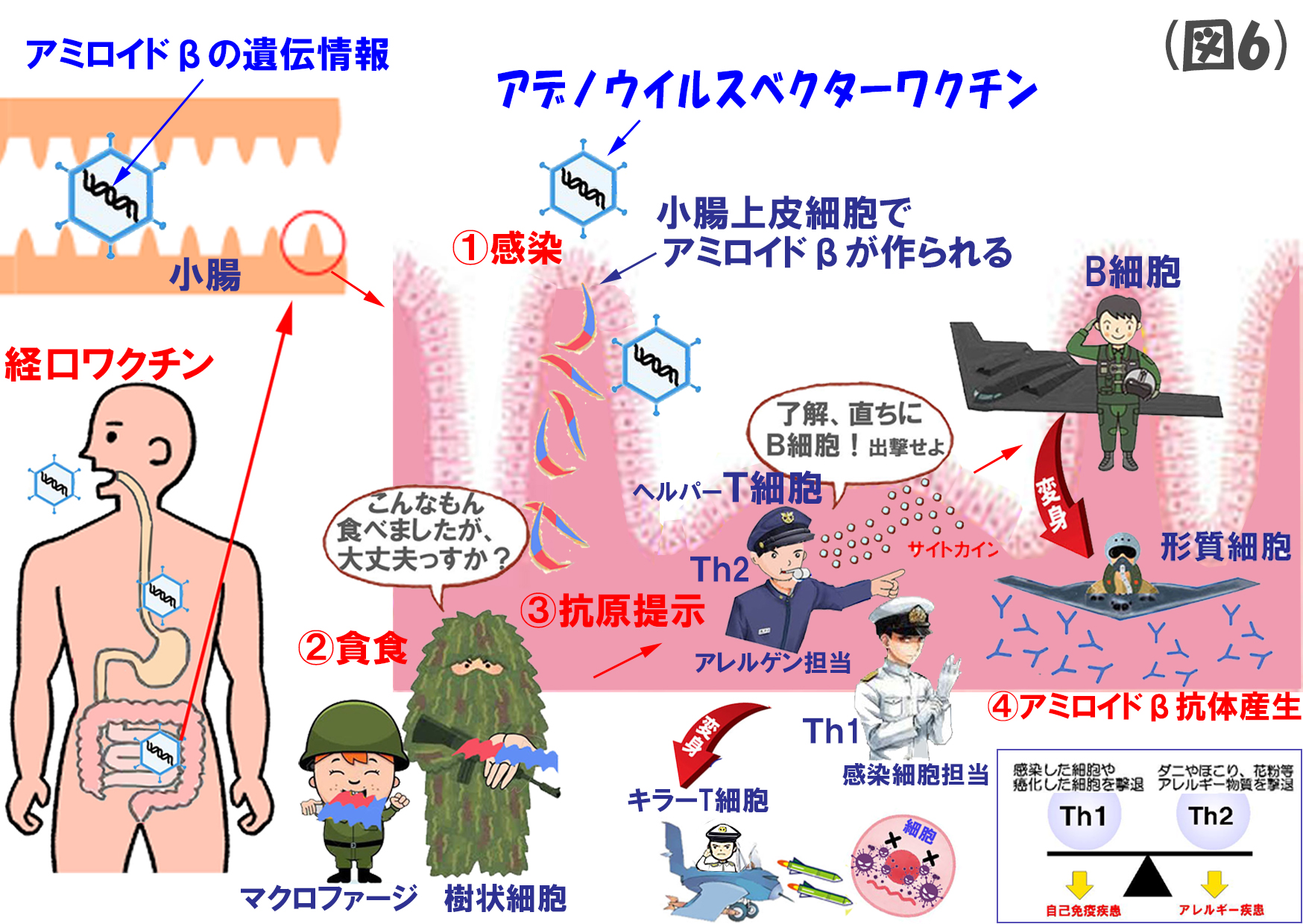
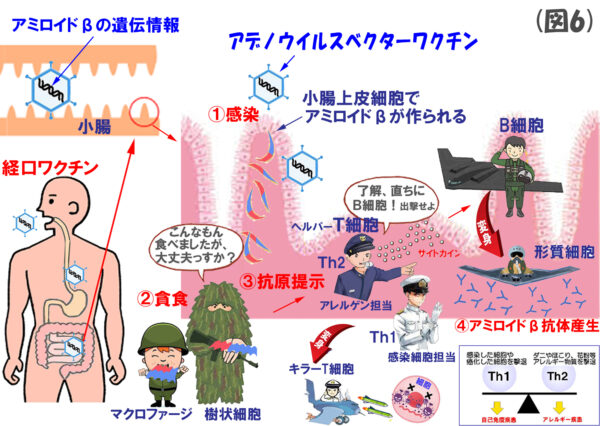
(図6)の説明
まずは、アミロイドβを発現できるアデノウイルスベクターを作成し、これを経口で投与します。感染後、腸管上皮細胞ではアミロイドβが発現し、前回投稿した流れでB細胞が抗アミロイドβ抗体を生産します。これは、たぶん、アストロゼネカのワクチンに近いやり方でしょうね。
経口ワクチンの主な利点としては、
- 1回の投与で約6か月間の長きにわたり抗原提示が得られること。
- 腸管上皮細胞は数日で新陳代謝されるので,遺伝子除去の必要がないこと。
- 運び屋(ベクター)のアデノウイルスは自己増殖せず、他の臓器に拡散しないこと。
- アジュバントを使わないために、T細胞の過剰な反応が惹起されないこと。
などを挙げておられます。
古来より、人間は、肉や魚といった様々な蛋白質を口から摂取していますが、これら蛋白質には脳炎を惹起する抗原が多く含まれています。その抗原がTh1 細胞を刺激すると,脳炎をはじめ自己免疫疾患をもたらす可能性が高くなります。そのため、腸管ではT細胞の反応, 特に Th1 反応を抑え,Th2 反応を高める免疫調節機構が備わっているそうです。
こんなシステムが人間にあるなら、使わない手はないじゃろ!
じゃ~、血液脳関門を通過した抗アミロイドβ抗体はどう戦うの?
最初に、小腸上皮細胞で作られた抗アミロイドβ抗体って、脳血管関門を通って脳に達することができるの?という疑問は多くの人が思うところです。その質疑応答は以下のとおりです。
質問:抗体は簡単に 血液脳関門(blood-brain barrier)を通ることができるのでしょうか?
回答:簡単には通りませんが、私たちの脳には脳血管関門のないところが 6 カ所あります。特に視床下部付近は血管に穴が空いていまして,それはホルモンの調節のためにわざわざ穴が空いているのですが,抗体はそこを通って視床下部に入ります.それは間質を通って全脳に広がることは解っています.ですから,徐々にですが,抗体は十分脳に到達できるのです。
へぇ~、意外とスンナリ問題解決したって感じ。素晴らしい!
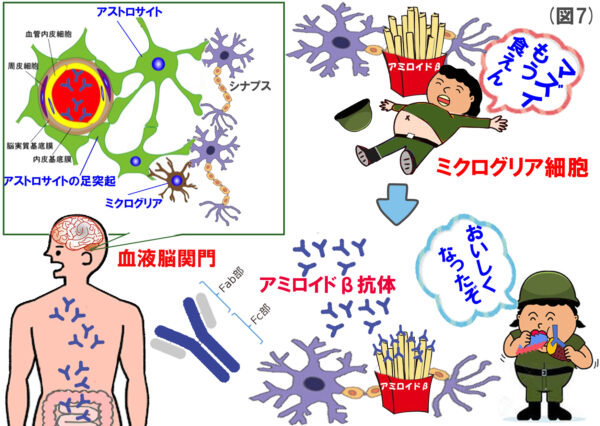
それでは、血液脳関門を突破した抗アミロイドβ抗体が、どのようにして脳内に溜まっているアミロイドβを除去するのかということですが、大きく3つの作用機序が提唱されています。(読み飛ばしてもいいと思いますが。)
①アミロイド貪食仮説
アミロイドβに抗体がくっつくとと、味が良くなり(オブソニン化)、ミクログリアの食欲を高める。
②引き抜き仮説
抗体が、凝集したアミロイドβにくっつくと可溶性が高まり、アミロイドβが溶けてしまう。
③凝集阻害、アミロイド融解仮説
抗体がアミロイドβのN末端にある標的シグナルに取付き,その凝集を阻害し,凝集したアミロイドβも融解する。
「ワクチン療法」の名付け親であるElan社のシェンク博士は、ミクログリアの貪食仮説を提唱していましたので、今回は「①の貪食仮説」に限って説明します。
(図7)の説明
貪食細胞であるミクログリアは、抗アミロイドβ抗体のFc部分が大好物なようで、Fc部分にある受容体を介してアミロイドβをよく貪食します。Fc部分とは、簡単に言うとYの形をした抗体の根本の部分です。実験で、Fc部分を除いた抗体を用いると、ミクログリアはあまり貪食しなくなるそうです。まさにオプソニン化ということで、前回投稿をご参照ください。
まとめ
日本語に訳された論文は、現在、英語で読まれている最先端の論文に比べ10年遅れていると言われます。おそらく、第一線の研究は、先の先を行っていて、アルツハイマーの経口ワクチン療法は実用化の一歩手前にあるものと期待しています。理想は、自己増殖型の経口mRNAワクチンということでしょうが、私のような老いぼれが、今から呑んでも手遅れでしょうね。
ん~、それでもええ、どうか先生、若いもんを救ってつかわさい! あんた、どこの国のもんとね?



コメント